1.5. Особенности химического состава природных вод Томской области |
1.3.2. Диссоциация в водных растворах
В 60 годах ХIХ в.в. Д.И. Менделеевым, на основании экспериментальных фактов, было выдвинуто предположение о существовании в растворах определенных химических соединений. Это предположение явилось основой химической теории растворов. В растворах частицы растворенного вещества связаны с окружающими их частицами растворителя. Эти комплексы называются сольватами, а для водных растворов гидратами. Растворенные молекулы и ионы образуют с водой соединения, благодаря межмолекулярному, донорно-акцепторному механизму взаимодействия и за счет образования водородных связей.
Так как вода является растворителем для многих веществ, то многие из них способны растворяться с образованием молекул и ионов. Растворы, в которых растворенное вещество находится в виде молекул, называются растворами неэлектролитов. Такие растворы не проводят электрический ток. Растворы, в которых растворенное вещество находится в виде ионов, называются растворами электролитов.
Природные воды являются растворами электролитов. Большая доля растворенного вещества находится в виде ионов, благодаря процессу диссоциации, т.е. распаду на ионы. Процесс диссоциации протекает обратимо и, следовательно, к нему применим закон действующих масс. Так для процесса диссоциации вещества АВ:
АВ ![]() А + В
А + В
закон действующих масс имеет вид:
Кр = Кд =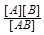 ,
,
где константа равновесия Кр для процесса диссоциации называется константой диссоциации Кд. Константа диссоциации является основной характеристикой водных растворов, позволяющей определять рН воды, соотношение ионного произведения растворимых соединений и произведения растворимости малорастворимых веществ. Эти константы водных растворов являются основными при расчете технологических процессов водоподготовки и очистки воды.
1.3.3. Буфферная система природных вод
В природных водах рН меняется незначительно. Неизменность рН в природных водах объясняется присутствием в них буферной системы, т.е. растворов смесей слабых кислот или слабых оснований с их солями. Концентрация водородных ионов в буферных растворах почти не изменяется при разбавлении их водой или добавлением небольших количеств щелочей или кислот. Это связано с тем, что рН таких вод определяется не концентрацией кислоты и ее соли, а отношением этих концентраций.
Например, ацетатный буфер содержит слабую кислоту СН3СООН и ее соль СН3СООNa. Аммиачный буфер содержит слабое основание NH4OH и соль NH4CI. Рассмотрим процесс диссоциации в растворе слабой кислоты и ее соли:
CH3COOH = CH3COOH- + H+
СН3СООNa = CH3COOH- + Na+