|
|
|
|
|
Влияние примесей на гигроскопические свойства технических продуктов 2.1. Общая характеристика чистого вещества и технического химического продукта В первой главе описывались гигроскопические свойства чистого вещества, но в практической деятельности чаще всего мы имеем дело не с чистыми веществами, а с техническими продуктами, которые всегда содержат некоторое количество примесей, способных существенно повлиять на картину взаимодействия основного вещества с влажным воздухом. Если химическое вещество выпускается каким-либо заводом как готовый коммерческий продукт, то его будем назвать техническим продуктом. Технический продукт – это вещество, получаемое в технологическом процессе, содержащее, кроме основного компонента, и другие компоненты, примеси, влияющие на свойства продукта. Причем количественное содержание и свойства примесей таковы, что их влиянием на некоторые (определенные) свойства технического продукта нельзя пренебречь. Содержание и свойства примесей, влияющих на свойства технического продукта, зависят от конкретных требований, предъявляемых к техническому продукту, от его назначения и определяются техническими условиями. Если для какой-то цели использования влиянием таких примесей можно пренебречь, то в этом случае такой технический продукт можно считать чистым веществом. Чистое вещество – определим как вещество, получаемое в технологическом процессе (который может включать дополнительную очистку), свойства которого определяются только основным компонентом, примеси на его свойства не влияют. Чистое вещество является чистым только с определенной точки зрения, только для определенных требований, для другой области применения оно может не считаться таковым. Определение гигроскопически чистого вещества было дано в первой главе. Гигроскопические свойства технического продукта, растворимого в воде, так же как и чистого вещества, определяются характеристиками насыщенного раствора (hг.т.), находящегося на поверхности его кристаллов, давлением паров воды над этим раствором. Однако этот насыщенный раствор на кристаллах технического продукта кроме основного компонента будет содержать в своем составе еще и примеси, которые могут существенно влиять на давление паров воды над таким раствором, а следовательно, и на гигроскопические свойства технического продукта. Из этого следует, что вид изотермы сорбции паров воды для технического продукта с примесью будет определяться системой «Основное вещество - примесь - вода». Примеси взаимодействуют с основным веществом различным образом. Можно выделить два крайних случая: - продукт с гетерогенной примесью, когда примесь и основное вещество представляют собой различные твердые фазы; раствор, насыщенный двумя компонентами, является простым эвтоническим раствором постоянного состава, - продукт с гомогенной примесью, когда примесь с основным веществом образует ряд непрерывных твердых растворов в твердой фазе; состав насыщенного раствора, находящегося в равновесии с твердой фазой, зависит от состава твердой фазы.
|
|
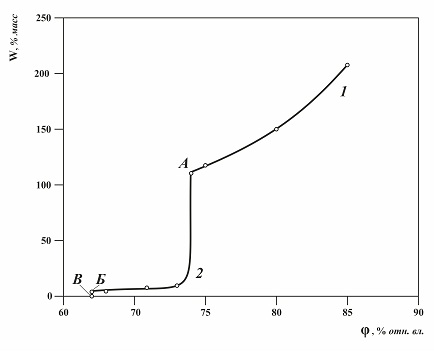
Рис. 2.1. Изотерма абсорбции паров воды нитратом натрия, содержащим в качестве гетерогенной примеси 1 % хлорида натрия. При низких значениях относительной влажности воздуха (участок изотермы от нуля до точки В) на рис. 2.1, конденсированная фаза системы представлена кристаллами основного вещества и примеси. В системе имеет место только физическая адсорбция воды на кристаллах. Значение равновесного влагосодержания на этом участке не превышает 0,01 % масс., так же как и для чистого вещества. Рассмотрим состояние системы в точке В. Присутствие примеси, контакт её кристаллов с кристаллами основного вещества, всегда снижает активность воды, при которой начинается абсорбция паров воды из газовой фазы с образованием раствора. Этот процесс начинается при строго определенной (для данной пары кристаллов) относительной влажности воздуха, которую назовем «критической относительной влажностью» (КОВ). Значение КОВ всегда ниже гигроскопических точек исходных веществ, иногда на десятки процентов. При φ = КОВ ( в точке В на изотерме) в конденсированной фазе появляется первая микрокапля жидкой фазы, представляющая собой эвтонический раствор – раствор, насыщенный одновременно обеими солями, который имеет наиболее низкую активность воды в рассматриваемой системе. Точка В характеризует момент перехода процесса адсорбции паров воды техническим продуктов в абсорбцию. Находясь в точке В, добавим некоторое небольшое количество паров воды в систему, после установления равновесия вся вода, добавленная в газовую фазу системы, переместится в конденсированную фазу. При этом относительная влажность в системе не изменится, останется равной КОВ, а влагосодержание образца увеличится, будет иметь вполне определенную измеряемую величину, количество эвтонического раствора увеличится, изотерма пойдет вверх, строго вертикально, как и в случае с чистым веществом. Гигроскопическая точка технического продукта (hг.т.) на участке ВБ будет постоянна и равна КОВ. На графике (рис. 2.1) участок ВБ, строго вертикален, как и участок БА на изотерме абсорбции чистого вещества (рис. 1.1), так как в обоих случаях участки отражает абсорбцию паров воды насыщенным раствором постоянного состава. Высота участка ВБ прямо пропорциональна содержанию примеси в техническом продукте. При этом у зависимости равновесного влагопоглощения от относительной влажности воздуха: при φ = КОВ возникает неопределенность: равновесное количество влаги может быть разным и находиться в диапазоне от минимального (точка В), до максимального (точка Б) значения. При дальнейшем добавлении паров воды в систему, система подходит к точке Б, по графику видно, что в точке Б система претерпевает кардинальное изменение. Оно заключается в том, что в системе растворяется последний микрокристалл примеси, исчезает твердая фаза примеси, т.к. вся примесь переходит в раствор. При дальнейшем увеличении относительной влажности воздуха, система будет характеризоваться участком БА. Ввод дополнительных паров в систему будет сопровождаться поглощением части паров и установлением равновесия в системе. Гигроскопическая точка технического продукта будет меняться, перемещаясь по линии БА. Поглощение влаги образцом на этом участке ведет к тому, что концентрация примеси в насыщенном растворе снижается, хотя количество примеси в образце в растворе остается неизменным, это происходит за счет разбавления раствора поглощаемой влагой из газовой фазы. Раствор в системе остается насыщенным относительно основного вещества, но его концентрация меняется и зависит как от содержания примеси, так и от относительной влажности воздуха. На участке БА при определенной относительной влажности воздуха равновесное влагосодержание прямо пропорционально концентрации примеси, содержащейся в сухом техническом продукте. Это свойство может быть использовано для количественного анализа примесей и для оценки степени чистоты вещества. В точке А изотермы (рис.2.1) относительную влажность воздуха можно назвать «критической влажность со штрихом» - КОВ'. В этой точке исчезает последний кристалл основного вещества и наблюдается переход от абсорбции паров воды насыщенным раствором к абсорбции ненасыщенным раствором. Абсорбция паров воды ненасыщенным раствором (выше точки А) рассматривалась при изучении абсорбции паров воды чистым веществом. Рассмотрим поведение гигроскопической точки продукта на участке ВБА. Гигроскопическая точка технического продукта на участке ВБА определяется этим графиком и ведет себя по-разному при изменении влажности технического продукта. Если принять что кривая БА является ограниченной гиперболой, содержащей горизонтальную ветвь, вершину (участок перегиба) и вертикальную ветвь, то можно выделить следующие участки на зависимости hг.т. = f(W). а) При появлении гетерогенной примеси в продукте и небольшой влажности (участок ВБ) гигроскопическая точка продукта скачком снижается от h*г.т. до значения КОВ, продукт становится более гигроскопичным. Снижение КОВ у продукта не зависит от содержания примеси, только от природы примеси, свойств (давления паров воды) эвтонического раствора. б) На участке горизонтальной ветви небольшие колебания влагосодержания приводят к существенным изменениям значений гигроскопической точки продукта. в) На участке вертикальной ветви большие колебания влагосодержания продукта практически не приводят к изменениям гигроскопической точки продукта. Если содержание примеси небольшое (не более 1 %), то КОВ' мало отличается от гигроскопической точки (h*г.т.) чистого вещества – основного компонента технического продукта. На вертикальном участке при влагосодержании 5 % и более, как видно из графика рис 2.1, гигроскопическая точка технического продукта приближается к КОВ', т.е. на вертикальном участке hг.т. ≈ КОВ' ≈ h*г.т. . Поэтому экспериментально определяемая гигроскопическая точка сильно увлажненного технического продукта может быть почти равна гигроскопической точке чистого продукта. Если сравнивать изотерму абсорбции гигроскопически чистого вещества (рис. 1.1) и изотерму абсорбции технического продукта с гетерогенной примесью (рис. 2.1), то можно отметить следующее. • На изотерме абсорбции паров воды у технического продукта с гетерогенной примесью, в отличие от изотермы абсорбции чистого вещества, появляется участок абсорбции паров воды ниже г.т. основного компонента, связанный с гетерогенной примесью. Такой продукт уже не является гигроскопически чистым. • На этом участке влагосодержание продукта прямо пропорционально концентрации примеси в сухом продукте. • При появлении гетерогенной примеси в чистом веществе гигроскопическая точка продукта может снижаться от h*г.т. до значения КОВ, при невысоком влагосодержании. • При φ = КОВ имеется разрыв на графике абсорбции паров воды техническим продуктом, связанный с эвтоническим раствором, постоянного состава насыщенным двумя солями, изотерма в этом месте строго вертикальна. • В отличие от чистого вещества технический продукт с гетерогенной примесью имеет не одно значение гигроскопической точки, а множество гигроскопических точек, образующих изотерму абсорбции паров воды этим продуктом. Каждая экспериментально полученная гигроскопическая точка на изотерме технического продукта должна характеризоваться не только значением относительной влажности, но и значением равновесного влагосодержания продукта при этой относительной влажности воздуха. • Гигроскопическая точка технического продукта с гетерогенной примесью – непостоянная величина, она зависит от содержания примеси и от влажности продукта. • Гигроскопическая точка достаточно увлажненного продукта становится практически равной гигроскопической точке чистого вещества - основного компонента продукта. • Гигроскопическая точка технического продукта находится между КОВ и КОВ' (КОВ <= hг.т <=КОВ'.) и может быть значительно ниже гигроскопической точки чистого вещества.
|
|
|
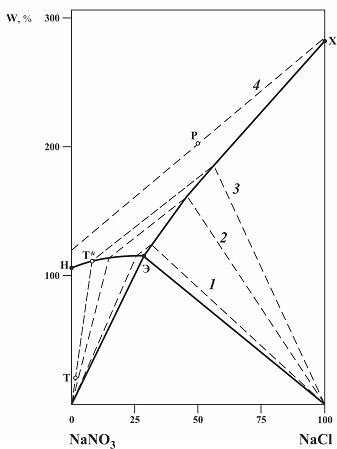
2.2.2. Диаграмма растворимости двух солей в воде. Для лучшего понимания свойств изотермы абсорбции паров воды техническим продуктом с гетерогенной примесью удобно анализировать её совместно с диаграммой растворимости двух солей. Для целей исследования гигроскопичности технических продуктов более наглядными являются диаграммы в координатах Енеке, которых в качестве координаты, характеризующей растворимость (вертикальная ось), используется ее обратная величина – влагосодержание (W), т.е. количество паров воды поглощенных продуктом в % масс. к сухому продукту, принимаемому за 100 %. Состав технического продукта (содержание примеси в % масс.) определяется по горизонтальной оси. Рис. 2.2. Диаграмма растворимости двух солей: нитрата натрия и хлорид натрия при 25°С с изоактиватами - линиями постоянной относительной влажности воздуха над растворами: 1 – 68,3, 2 – 70,8, 3 – 72,7, 4 – 76,0 % отн. вл. в. Прежде чем анализировать изотерму совместно с диаграммой, рассмотрим более подробно саму диаграмму растворимости (рис.2.2), а также расчет состава компонентов в некоторых точках. Основными линиями диаграммы являются линии насыщенных растворов НЭ и ХЭ, основные точки: 0 – соответствует сухому чистому (100%) нитрату натрия, 100 - соответствует сухому чистому хлориду натрия, Н - соответствует насыщенному раствору чистого нитрата натрия, Х - соответствует насыщенному раствору чистого хлорида натрия, Э - соответствует эвтоническому раствору, насыщенному обеими солями. Поле разбавленных растворов, которое расположено выше линий насыщенных растворов НЭ и ХЭ, оно характеризует состав растворов и активность воды в них. Точки с одинаковыми активностью воды являются на этой диаграмме прямыми отрезками (изоактиватами), в рассматриваемом случае они идут параллельно друг другу. Изоактиваты ограниченны линиями насыщенных растворов или границами диаграммы. Точки, лежащие на линиях насыщенных растворов, относятся к растворам, насыщенным по нитрату натрия и хлориду натрия соответственно. Рассмотрим произвольную точку Р, характеризующую разбавленный раствор двух солей. По диаграмме можно определить состав и свойства конкретного образца, например, массой 12 грамм, соответствующий этой точке: - содержание 2-го компонента (NaCl): 50 % от суммы твердых веществ, - содержание 1-го компонента (NaNO3): 100 – 50 = 50 % от суммы твердых веществ, - содержание воды: 200 % к сумме твердых веществ, - активность воды в этой точке, лежащей на линии постоянной относительной влажности αw,Р = 0,760. Таким образом, образец массой в 12 грамм, соответствующий точке Р, содержит воды WобН2О = 12 * 200 / (100 + 200) = 8 грамм. Следовательно, образец содержит 8 грамм воды и 4 грамма солей (2 г NaNO3 и 2 г NaCl) и представляет собой разбавленный раствор этих солей. Точка Э определяет состав и свойства эвтонического раствора. По диаграмме находим: - содержание 2-го компонента (NaCl): 30 % от суммы твердых веществ, - содержание 1-го компонента (NaNO3): 100 – 30 = 70 % от суммы твердых веществ, - содержание воды: 118 % к сумме твердых веществ - активность воды в эвтоническом растворе, α*w = 0,672 Таким образом, образец массой в 12 грамм, соответствующий точке Э, содержит воды WобН2О = 12 * 118 / (100+118) = 6,5 грамм. Следовательно, образец содержит 6,5 грамм воды, (12 – 6,5)*0,7 = 3,9 грамма NaNO3 и (12 – 6,5)*0,3 = 1,6 грамма NaCl. Поле кристаллизации нитрата натрия 0НЭ характеризует образцы, содержащие кристаллы нитрата натрия, и раствор, насыщенный относительно нитрата натрия и содержащий хлорид натрия. Состав и свойства раствора, характеризуются точкой (Т*) на линии насыщенных растворов НЭ, полученной при проведении луча из нулевой точки через точку образца (Т) до линии насыщенных растворов. Этот луч одновременно является линией постоянной относительной влажности (изоактиватой). Рассмотрим в этом поле образец, который характеризуется точкой Т. По диаграмме для этой точки напрямую можем определить содержание хлорида натрия (П = 1% масс.) в общей массе сухих солей по горизонтальной оси и содержание воды на сумму солей в образце (W = 11,3%) по вертикальной оси.». Расчет массы воды в образце (WобН2О) по массе образца (12 грамм): WобН2О =12 * 11,3 / (100 + 11,3) = 1,2 грамма. Но это состав образца, который состоит из кристаллов и раствора. Состав раствора и активность воды в нем определяется лучом, выходящим из точки 0 и проходящим через точку Т, а сами значения состава определяется в точке пересечения этого луча с линией насыщенных растворов НЭ - точкой Т*. По диаграмме для точки Т*: - содержание воды в растворе: 113 % на 100 грамм сухих солей, - состав солей: NaCl = 9 %, NaNO3 =91 % и - активность воды: αw = 0,727. Расчет массы раствора в образце (Мр-р) по массе воды (1,2) в образце Мр-р = 1,2 * (100 + 113) / 113 = 2,3 грамма. Расчет общей массы солей в растворе (Мс,р-р) по массе раствора Мс,р-р = 2,3* 100 / (100 + 113) = 1.1 грамма. Масса отдельных солей в растворе МNaCl = 1,1 * 0,09 = 0,1 грамма, МNaNO3 = 1,1 * 0,91 = 1,0 грамма. Масса кристаллов в образце Мкр = Моб - Мр-р = 12 – 2,3 = 9,7 грамма. Общая масса солей в образце Моб.с. = Мс,р-р + Мкр = 1,1 + 9,7= 10,8 грамма. Поле кристаллизации хлорида натрия ЭХ100 - оно характеризует образцы, содержащие кристаллы хлорида натрия и раствор, насыщенный относительно хлорида натрия, содержащий нитрат натрия. Поле содержит изоактиваты, которые соединяют точки на линии насыщенных растворов ЭХ с точкой 100. Состав и свойства раствора, характеризуются точкой на линии насыщенных растворов ЭХ, полученной при проведении луча из точки 100 через точку образца до линии насыщенных растворов. Поле кристаллизации нитрата натрия и хлорида натрия 0Э100 - несмотря на то, что это поле, состав всех растворов в этом поле характеризуется одной точкой Э - точкой эвтонического раствора. В точках этого поля образец содержит в разных соотношениях кристаллы двух солей - нитрата и хлорида натрия - и раствор, насыщенный относительно этих солей. Образец, соответствующий точке 0, будет представлять собой чистый нитрат натрия, соответствующий точке 100, будет представлять чистый хлорид натрия, а образец, соответствующий точке «Э», будет содержать только эвтонический раствор, без кристаллов.
|
|
|
 2.2.3. Совместное рассмотрение диаграммы растворимости двух солей и изотермы сорбции. Рассмотрим совместно изотерму сорбции технического продукта, содержащего гетерогенную примесь и диаграмму растворимости двух солей (рис.2.4). Видно, что изотерма является срезом диаграммы, отражающей различные состояния системы «Основное вещество – примесь - вода» с фиксированным значением примеси (П). Каждой характерной точке на изотерме сорбции соответствуют аналогичные точки, связанные с пересечением границ, рассмотренных полей диаграммы растворимости солей. Диаграмма дает более обобщенную картину гигроскопических свойств системы «Основное вещество - примесь». Рис.2.3 Диаграмма растворимости двух солей, образующих простую эвтонику (а), и изотерма сорбции паров воды продуктом, содержащим гетерогенную примесь (б). Гигроскопическая точка технического продукта с гетерогенной примесью в зависимости от его влажности может изменяться от КОВ до КОВ'. Из сравнения изотермы и диаграммы видно, что КОВ – это относительная влажность воздуха над эвтоническим раствором (hэ – гигроскопическая точка эвтонического раствора), поэтому она не зависит от содержания влаги и примеси в техническом продукте. Значение КОВ – константа для технического продукта с одной определенной примесью. Гигроскопическая точка эвтонического раствора всегда ниже, чем гигроскопические точки отдельных чистых веществ, составляющих раствор. Причем понижение в зависимости от природы компонентов может составлять как незначительную величину, так и несколько десятков процентов относительной влажности.
2.2.3. Совместное рассмотрение диаграммы растворимости двух солей и изотермы сорбции. Рассмотрим совместно изотерму сорбции технического продукта, содержащего гетерогенную примесь и диаграмму растворимости двух солей (рис.2.4). Видно, что изотерма является срезом диаграммы, отражающей различные состояния системы «Основное вещество – примесь - вода» с фиксированным значением примеси (П). Каждой характерной точке на изотерме сорбции соответствуют аналогичные точки, связанные с пересечением границ, рассмотренных полей диаграммы растворимости солей. Диаграмма дает более обобщенную картину гигроскопических свойств системы «Основное вещество - примесь». Рис.2.3 Диаграмма растворимости двух солей, образующих простую эвтонику (а), и изотерма сорбции паров воды продуктом, содержащим гетерогенную примесь (б). Гигроскопическая точка технического продукта с гетерогенной примесью в зависимости от его влажности может изменяться от КОВ до КОВ'. Из сравнения изотермы и диаграммы видно, что КОВ – это относительная влажность воздуха над эвтоническим раствором (hэ – гигроскопическая точка эвтонического раствора), поэтому она не зависит от содержания влаги и примеси в техническом продукте. Значение КОВ – константа для технического продукта с одной определенной примесью. Гигроскопическая точка эвтонического раствора всегда ниже, чем гигроскопические точки отдельных чистых веществ, составляющих раствор. Причем понижение в зависимости от природы компонентов может составлять как незначительную величину, так и несколько десятков процентов относительной влажности.
|
|
|
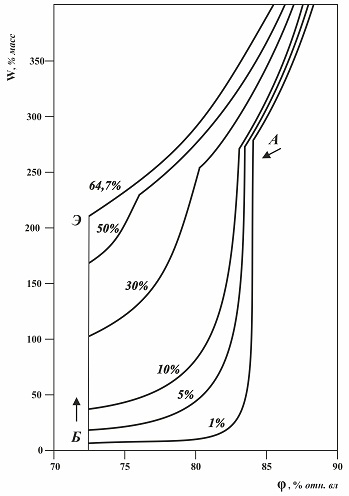
Рис.2.4. Изотермы абсорбции влаги смесями хлорида калия и хлорида натрия (цифрами дано содержание хлорида натрия в масс %) при 25 °С. КОВ' - это относительная влажность воздуха, определяемая по линии насыщенных растворов, она не зависит от влажности продукта, но зависит от содержания примеси. КОВ' – это константа для технического продукта с определенным содержанием примеси. При увеличении концентрации примеси в продукте значение КОВ' перемещается от относительной влажности воздуха, соответствующей гигроскопической точки основного вещества к гигроскопической точке эвтонического раствора (рис 2.4). При соотношении солей в образце, равном эвтоническому, КОВ' совпадает с КОВ, а изотерма абсорбции для смеси солей эвтонического соотношения приобретает вид изотермы абсорбции паров воды гигроскопически чистым веществом. При содержании примеси в веществе до 1 % перемещение КОВ' относительно значения гигроскопической точки чистого вещества незначительно; практически КОВ' совпадает с гигроскопической точкой основного вещества. Поэтому технические продукты с небольшим (до 1 %) содержанием примесей, увлажненные до 5 %, экспериментально дают значение гигроскопической точки продукта близкое к значению гигроскопической точки основного компонента такого продукта. На диаграмме растворимости нет полей и точек с активностью воды ниже, чем у поля 1Э100, поэтому при относительной влажности воздуха ниже КОВ технический продукт не адсорбирует влагу, возможна только адсорбция влаги до 0,01 % масс. Как отмечалось выше, наибольший интерес представляет та часть изотермы абсорбции, которая определяется примесью: вертикальный отрезок ВБ и кривая БА, так как при влажности продукта от 0,01 до 5 % гигроскопическая точка технического продукта определяется именно этой частью изотермы. Диаграмма наглядно показывает, что на участке изотермы БА равновесное количество влаги (Wφп % масс.), поглощаемое техническим продуктом с содержанием примеси П, % масс., при значении относительной влажности воздуха φ прямо пропорционально содержанию примеси: Wφп = Wφ1%*П - - - 2.1 где Wφ1% – равновесное влагопоглощение продукта с 1% примеси при определенной относительной влажности воздуха. Использование этой формулы основано на том, что точки, характеризующие образец (при П < Э) на диаграмме, лежат в поле 0НЭ, где линии постоянной относительной влажности воздуха на диаграмме растворимости выходят из нулевой точки (рис. 2.3, а). При относительной влажности выше точки А абсорбция до равновесного состояния приводит к образованию ненасыщенных растворов. На диаграмме – это поле разбавленных растворов выше линий насыщения. Чем выше относительная влажность воздуха, тем больше паров воды поглощает образец, при этом образуется более разбавленный раствор. Если водный раствор двух солей, не образует комплексных соединений, двойных солей, как в рассматриваемом случае, то расчет равновесного количества влаги в % масс., поглощенной образцом сухой соли, содержащей в своем составе П процентов примеси при относительной влажности воздуха равной φ, можно вести по формуле: , 2.2. где – равновесное влагосодержание чистого основного вещества при том же значении φ, % масс – то же для чистой примеси. Значения Wφ по многим веществам можно рассчитать (по формулам 1.3 – 1.5) на основе справочных данных – таблиц активности воды в растворах. • КОВ – константа для технического продукта с определенной гетерогенной примесью. • КОВ' – это константа для технического продукта с определенным значением содержания гетерогенной примеси.
|
|
|
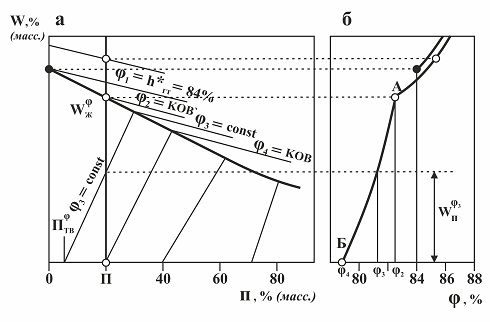 2.3. Гигроскопичность продукта с гомогенной примесью. Изотерму сорбции технического вещества с гомогенной примесью рассмотрим совместно с диаграммой растворимости солей, они приведены на рис. 2.5. Данные взяты из работы [12] для системы КСl (h*г.т.=84,3; W*=278 %) RbCl (h*г.т.=75,1; W*=106 %). Диаграмма содержит одну линию насыщенных растворов, выше её область разбавленных растворов, ниже область насыщенных растворов, сосуществующих со смешанными кристаллами (твердыми растворами солей). Линии постоянной относительной влажности воздуха на диаграмме растворимости солей, выходят не из начала координат и ограничены снизу точками, характеризующими состав твердой фазы с координатами Пφтв, 0, а на линии насыщенных растворов точками, характеризующими состав жидкой фазы с координатами Пφж, Wφж. Рис. 2.5. Диаграмма растворимости (а) двух солей в воде, образующих непрерывный ряд твердых растворов, и изотерма абсорбции (б) паров воды техническим продуктом, содержащим П = 20 % масс. гомогенной примеси. От диаграммы растворимости солей можно перейти к изотерме абсорбции паров воды техническим продуктом, содержащим определенное количество гомогенной примеси (рис. 2.5), путем перенесения на изотерму показаний точек пересечения линий постоянной относительной влажности и кривой растворимости с вертикальной прямой, отражающей на диаграмме процесс увлажнения исходного сухого продукта. По аналогии с ранее рассмотренным случаем относительная влажность воздуха в точке Б можно назвать КОВ, а в точке А - КОВ' – смысл КОВ и КОВ' тот же. Однако на диаграмме растворимости нет эвтонического раствора, поэтому КОВ не является константой двойной системы, в данном случае КОВ и КОВ/ являются константами только технического продукта с определенным значением содержания примеси. Гигроскопическая точка технического продукта с гомогенной примесью, как и в предыдущем случае, может изменяться от КОВ до КОВ', в зависимости от влажности продукта. Равновесное влагосодержание образца технического продукта Wφп, между точками А и Б изотермы при каждом заданном значении относительной влажности воздуха φ можно определить по формуле: Wφп = Wφж * (П – Пφтв) / ( Пφж – Пφтв) 2.3 где Wφж - равновесное количество воды в насыщенном растворе при определенном значении φ, отнесенное к сумме солей в растворе, % масс. П – содержание примеси к сумме содей (в сухом техническом продукте), % масс. Пφтв - содержание примеси в кристаллах твердой фазы, равновесной с насыщенным раствором при определенном значении φ, в техническом продукте, % масс.; Пφж – содержание примеси в насыщенном растворе при определенном значении φ, отнесенное к исходному сухому техническому продукту, % масс.; Анализ диаграммы растворимости двух солей, образующих твердые растворы, и соответствующей ей изотермы абсорбции показывает, что небольшое количество гомогенной примеси (до 1 %) может несколько увеличить или уменьшить значение гигроскопической точки технического продукта, но это величина этого изменения вряд ли может быть больше погрешности измерения гигроскопической точки. Следует заметить, что примесь и основное веществом могут образовывать твердый раствор, как правило, только имея достаточно близкие физико-химические свойства, том числе и по давлению паров воды над насыщенным раствором. Рассматривая различия гигроскопических свойств технических продуктов с гомогенной и гетерогенной примесью, прежде всего, следует отметить, что наиболее заметно на гигроскопичность влияет гетерогенная примесь. Доли процента этой примеси могут перевести основное вещество из категории негигроскопичных в чрезвычайно гигроскопичные. Гомогенная же примесь оказывает влияние в меньшей степени. Изотерма абсорбции для продукта с гомогенной примесью лишь незначительно отличается от изотермы абсорбции чистого вещества, особенно, если содержание примеси в нем до 1 %. • Гигроскопические свойства технического продукта с гомогенной примесью мало отличаются от гигроскопических свойств чистого вещества – основного компонента продукта. • КОВ и КОВ' являются константами технического продукта с определенным значением гомогенной примеси.
2.3. Гигроскопичность продукта с гомогенной примесью. Изотерму сорбции технического вещества с гомогенной примесью рассмотрим совместно с диаграммой растворимости солей, они приведены на рис. 2.5. Данные взяты из работы [12] для системы КСl (h*г.т.=84,3; W*=278 %) RbCl (h*г.т.=75,1; W*=106 %). Диаграмма содержит одну линию насыщенных растворов, выше её область разбавленных растворов, ниже область насыщенных растворов, сосуществующих со смешанными кристаллами (твердыми растворами солей). Линии постоянной относительной влажности воздуха на диаграмме растворимости солей, выходят не из начала координат и ограничены снизу точками, характеризующими состав твердой фазы с координатами Пφтв, 0, а на линии насыщенных растворов точками, характеризующими состав жидкой фазы с координатами Пφж, Wφж. Рис. 2.5. Диаграмма растворимости (а) двух солей в воде, образующих непрерывный ряд твердых растворов, и изотерма абсорбции (б) паров воды техническим продуктом, содержащим П = 20 % масс. гомогенной примеси. От диаграммы растворимости солей можно перейти к изотерме абсорбции паров воды техническим продуктом, содержащим определенное количество гомогенной примеси (рис. 2.5), путем перенесения на изотерму показаний точек пересечения линий постоянной относительной влажности и кривой растворимости с вертикальной прямой, отражающей на диаграмме процесс увлажнения исходного сухого продукта. По аналогии с ранее рассмотренным случаем относительная влажность воздуха в точке Б можно назвать КОВ, а в точке А - КОВ' – смысл КОВ и КОВ' тот же. Однако на диаграмме растворимости нет эвтонического раствора, поэтому КОВ не является константой двойной системы, в данном случае КОВ и КОВ/ являются константами только технического продукта с определенным значением содержания примеси. Гигроскопическая точка технического продукта с гомогенной примесью, как и в предыдущем случае, может изменяться от КОВ до КОВ', в зависимости от влажности продукта. Равновесное влагосодержание образца технического продукта Wφп, между точками А и Б изотермы при каждом заданном значении относительной влажности воздуха φ можно определить по формуле: Wφп = Wφж * (П – Пφтв) / ( Пφж – Пφтв) 2.3 где Wφж - равновесное количество воды в насыщенном растворе при определенном значении φ, отнесенное к сумме солей в растворе, % масс. П – содержание примеси к сумме содей (в сухом техническом продукте), % масс. Пφтв - содержание примеси в кристаллах твердой фазы, равновесной с насыщенным раствором при определенном значении φ, в техническом продукте, % масс.; Пφж – содержание примеси в насыщенном растворе при определенном значении φ, отнесенное к исходному сухому техническому продукту, % масс.; Анализ диаграммы растворимости двух солей, образующих твердые растворы, и соответствующей ей изотермы абсорбции показывает, что небольшое количество гомогенной примеси (до 1 %) может несколько увеличить или уменьшить значение гигроскопической точки технического продукта, но это величина этого изменения вряд ли может быть больше погрешности измерения гигроскопической точки. Следует заметить, что примесь и основное веществом могут образовывать твердый раствор, как правило, только имея достаточно близкие физико-химические свойства, том числе и по давлению паров воды над насыщенным раствором. Рассматривая различия гигроскопических свойств технических продуктов с гомогенной и гетерогенной примесью, прежде всего, следует отметить, что наиболее заметно на гигроскопичность влияет гетерогенная примесь. Доли процента этой примеси могут перевести основное вещество из категории негигроскопичных в чрезвычайно гигроскопичные. Гомогенная же примесь оказывает влияние в меньшей степени. Изотерма абсорбции для продукта с гомогенной примесью лишь незначительно отличается от изотермы абсорбции чистого вещества, особенно, если содержание примеси в нем до 1 %. • Гигроскопические свойства технического продукта с гомогенной примесью мало отличаются от гигроскопических свойств чистого вещества – основного компонента продукта. • КОВ и КОВ' являются константами технического продукта с определенным значением гомогенной примеси.
|
|
|
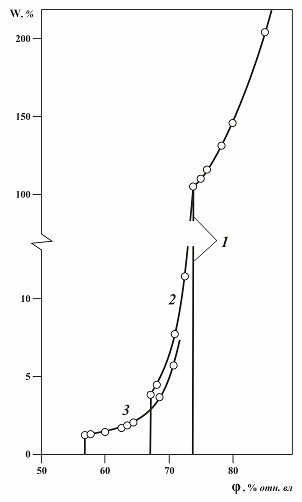 2.4. Технические продукты с двумя примесями и более. Из сравнения влияния гомогенной и гетерогенной примесей на гигроскопические свойства растворимых веществ следует, что наиболее интересно влияние гетерогенной примеси, поэтому далее будет рассматриваться, прежде всего, их влияние . Выше было рассмотрено влияние одной примеси хлорида натрия на гигроскопические свойства нитрата натрия, однако техническая натриевая селитра может содержать и другие примеси. Например, натриевая селитра 1-го сорта, выпускаемая по ГОСТ 828-54, не должна содержать хлорида натрия более 0,5 % и нитрита натрия более 0,02 %. Поэтому ниже рассмотрено влияние двух гетерогенных примесей, как по отдельности, так и вместе на гигроскопические свойства технического продукта на примере натриевой селитры. Рис. 2.6. Изотермы сорбции паров воды образцами нитрата натрия при 25°C. W – равновесное влагопоглощение, % маcс., φ – относительная влажность воздуха, % отн. вл. в. 1 – нитрат натрия гигроскопически чистый; 2– нитрат натрия с 1 % примеси хлорида натрия; 3 – нитрат натрия с 1 % примеси нитрита натрия; На рис 2.6 и в таблице 2.1 представлены экспериментальные изотермы абсорбции чистого нитрата натрия и образцов нитрата натрия, содержащего по одной примеси [6]. Нитрат натрия с примесью хлорида натрия имеет КОВ = 67,2 %, с примесью нитрита натрия имеет КОВ = 57,0 %. Таким образом, гигроскопическая точка продукта, содержащего примесь хлорида натрия, сдвигается относительно гигроскопической точки чистого вещества примерно на 7 %, а для продукта с нитритом натрия - на 17 %. Примесь нитрита натрия в большей степени усиливает гигроскопические свойства селитры, имея ввиду увеличение диапазона относительной влажности воздуха, при котором происходит увлажнение продукта. При φ = 70,8 % отн. вл. в влагосодержание натриевой селитры с 1% хлорида натрия равно 7,6 %, а с 1% нитрита натрия 5,7 % то есть достаточно близки. Однако масса влаги, поглощаемой в реальном техническом продукте за счет нитрита значительно меньше, если учесть, что его более чем в 10 раз меньше, чем хлорида.
2.4. Технические продукты с двумя примесями и более. Из сравнения влияния гомогенной и гетерогенной примесей на гигроскопические свойства растворимых веществ следует, что наиболее интересно влияние гетерогенной примеси, поэтому далее будет рассматриваться, прежде всего, их влияние . Выше было рассмотрено влияние одной примеси хлорида натрия на гигроскопические свойства нитрата натрия, однако техническая натриевая селитра может содержать и другие примеси. Например, натриевая селитра 1-го сорта, выпускаемая по ГОСТ 828-54, не должна содержать хлорида натрия более 0,5 % и нитрита натрия более 0,02 %. Поэтому ниже рассмотрено влияние двух гетерогенных примесей, как по отдельности, так и вместе на гигроскопические свойства технического продукта на примере натриевой селитры. Рис. 2.6. Изотермы сорбции паров воды образцами нитрата натрия при 25°C. W – равновесное влагопоглощение, % маcс., φ – относительная влажность воздуха, % отн. вл. в. 1 – нитрат натрия гигроскопически чистый; 2– нитрат натрия с 1 % примеси хлорида натрия; 3 – нитрат натрия с 1 % примеси нитрита натрия; На рис 2.6 и в таблице 2.1 представлены экспериментальные изотермы абсорбции чистого нитрата натрия и образцов нитрата натрия, содержащего по одной примеси [6]. Нитрат натрия с примесью хлорида натрия имеет КОВ = 67,2 %, с примесью нитрита натрия имеет КОВ = 57,0 %. Таким образом, гигроскопическая точка продукта, содержащего примесь хлорида натрия, сдвигается относительно гигроскопической точки чистого вещества примерно на 7 %, а для продукта с нитритом натрия - на 17 %. Примесь нитрита натрия в большей степени усиливает гигроскопические свойства селитры, имея ввиду увеличение диапазона относительной влажности воздуха, при котором происходит увлажнение продукта. При φ = 70,8 % отн. вл. в влагосодержание натриевой селитры с 1% хлорида натрия равно 7,6 %, а с 1% нитрита натрия 5,7 % то есть достаточно близки. Однако масса влаги, поглощаемой в реальном техническом продукте за счет нитрита значительно меньше, если учесть, что его более чем в 10 раз меньше, чем хлорида.
|
|
|
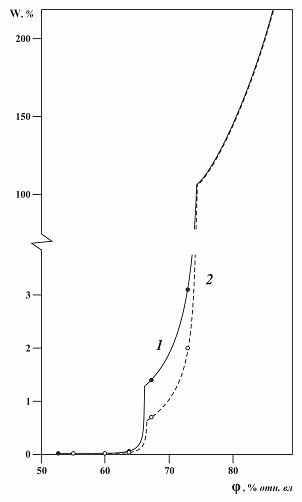
Рис. 2.7. Изотермы абсорбции паров воды образцами натриевой селитры при 25°C. W – равновесное влагопоглощение, % маcс., φ - относительная влажность воздуха, % отн. вл. в. 1 — промышленный образец, содержащий 0,34 % хлорида натрия и 0,02 % нитрита натрия; 2 – модельный образец, содержащий 0,2 % хлорида натрия и 0,015 %.нитрита натрия Совместное влияние примесей на гигроскопичность нитрата натрия иллюстрируется изотермой абсорбции паров воды для модельного образца технической селитры, приготовленного на основе гигроскопически чистых веществ: нитрата натрия, хлорида натрия (0,2 %) и нитрита натрия (0,015 %) (рис .2.7 и таблица 2.1). Там же приведена изотерма абсорбции паров воды промышленным образцом натриевой селитры, содержащим, по результатам химанализа, 0,34 % хлорида натрия и 0,02 % нитрита натрия: На изотермах абсорбции для модельного и промышленного образцов натриевой селитры ниже гигроскопической точки чистого нитрата натрия можно выделить две области абсорбции паров воды: - от 54.8 % отн. вл. в. (КОВ тройной солевой системы: нитрат – хлорид – нитрит натрия) до 67 % (КОВ двойной системы нитрат – хлорид натрия) с уровнем влагопоглощения 0,02 – 0,06 % масс., - от 67 % до 73 % (относительной влажности близкой КОВ/), с уровнем влагопоглощения 0,7 – 3 % масс., В первой области равновесное количество абсорбированной влаги определяется в основном влиянием нитрита натрия. Из-за небольшого содержания нитрита в селитре количество абсорбированной влаги лишь чуть выше чувствительности взвешивания навески на аналитических весах. Во второй области абсорбция зависит главным образом от хлорида натрия, при этом равновесное влагопоглощение, учитывая незначительное содержание нитрита натрия, практически пропорционально количеству хлорида натрия. Между этими областями наблюдается излом на изотерме абсорбции, связанный с растворением одной из твердых фаз – хлорида натрия. При рассматриваемых концентрациях примесей в селитре он достаточно четкий, поэтому значения влагопоглощения возрастают на порядок с 0,1 % до 1 %. Следует отметить, что если бы соотношение примесей было другим (хлорида меньше, чем нитрата), то излом на изотерме был бы незаметен. Модельный образец селитры не содержит других примесей, кроме введенных, поэтому у него обнаруживается, хотя и небольшой (на уровне чувствительности метода), но вертикальный участок изотермы соответствующий КОВ системы трех солей при 54,8 % отн. вл. в. (табл. 2.1). Для промышленного образца прогиб кривой на изотерме абсорбции в этом районе относительных влажностей воздуха экспериментально не обнаруживается, из-за наличия других более гигроскопичных примесей (например, нитраты кальция, магния) в технической селитре. За счет таких примесей промышленный образец селитры поглощает влагу ниже КОВ системы трех солей, в то время как модельный не поглощает. Технические продукты в своем составе содержат, как правило, не одну - две, а целый спектр примесей. Появлению каждой новой водорастворимой гетерогенной примеси (твердой фазы) в исходном техническом продукте будет соответствовать свой излом на изотерме абсорбции паров воды. Чем больше число твердых фаз (примесей) в продукте, тем больше точек излома на изотерме. Но с появлением каждой новой примеси эти изломы становятся все менее выраженными, поэтому для промышленных продуктов, содержащих широкий набор примесей, изотерма абсорбции паров воды ниже гигроскопической точки основного компонента будет иметь вид весьма плавной кривой. Равновесная изотерма абсорбция паров воды ниже гигроскопической точки основного компонента технического продукта – это отражение состава растворимых примесей, поэтому изотерма достаточно индивидуальна для конкретной технологии получения продукта и даже партии продукта. Гигроскопичность многокомпонентных продуктов определяется аналогичным образом с привлечением диаграмм растворимости. • Каждая гетерогенная примесь вносит свой вклад в изотерму абсорбции паров воды техническим продуктом ниже гигроскопической точки основного компонента. • При большом количестве примесей в техническом продукте влияние каждой отдельной примеси на изотерму абсорбции сглаживается.
|
|
|

2.6. Адсорбция и абсорбция растворимых веществ. Довольно часто сорбцию паров воды твердыми растворимыми веществами в небольших количествах (0,01 – 1,0 %), если она не ведет к видимому растворению вещества (то есть ниже гигроскопической точки основного вещества), относят к физической адсорбции, капиллярной конденсации и др. При этом даже не делается попытки оценить содержание растворимых примесей в таких продуктах и отнести сорбцию к абсорбции влаги за счет растворимых гигроскопичных примесей. Знание общего вида изотерм сорбции технических продуктов, у которых основной компонент – растворимое вещество, позволяет относить сорбцию паров воды ниже гигроскопической точки основного компонента, прежде всего за счет абсорбции растворимых примесей и микропримесей, если влагопоглощение превышает величину в 0,01 % масс. Расчеты показывают, что мономолекулярная адсорбция при размерах кристаллов продукта от 0,01 мм и более существенно меньше 0,01 %, т.е. меньше чувствительности взвешивания на обычных аналитических весах. То же самое показывают и экспериментальные данные, выполненные более чувствительными методами (рис. 2.8) с особо чистым веществом. Рис. 2.8. Изотерма сорбции паров воды хлоридом натрия: 1 – изотерма адсорбции, 2 – изотерма абсорбции. Технические продукты в общем случае могут содержать растворимые примеси и микропримеси, влияющие на гигроскопичность, что рассмотрено выше. Если образец является техническим продуктом (не подвергался специальной очистке от примесей), то попытки объяснить сорбцию паров воды (при W => 0,01 % масс.) ниже гигроскопической точки основного компонента за счет адсорбции основным компонентом выглядят неубедительным. В этом случае гравиметрическим или объемным методами трудно отличить адсорбцию основным компонентом от абсорбции за счет микропримесей. При необходимости оценить характер сорбции следует привлекать другие методы исследования состояния воды на поверхности вещества. Вместе с тем надо учитывать, что мономолекулярная физическая адсорбция паров воды веществом не приводит к образованию жидкой фазы на поверхности вещества, поэтому не может повлиять, например, на слеживаемость вещества. Если рассматривается смесь веществ, то адсорбция не может привести к химическому взаимодействию между разными веществами через жидкую фазу, а абсорбция за счет микропримесей может. В тоже время адсорбция паров воды у продуктов с развитой поверхностью: силикагели, ультрадисперсные порошки, наноматериалы, может составлять несколько десятков процентов. • Сорбция паров воды растворимым продуктом при относительной влажности ниже его гигроскопической точки, если она выше 0,01 % вероятнее всего определяется абсорбцией за счет его микропримесей, а не его адсорбцией.
|
|
|
 |
|
|
|
|