|
|
|
|
|
1. Гигроскопичность чистых веществ 1.1. Общие сведения Гигроскопичность (hygroscopicity) – это свойство веществ поглощать влагу из воздуха. Влагу из воздуха поглощают разные виды веществ, технических продуктов и материалов, например, древесина, цеолиты, полимеры, но в дальнейшем будем рассматривать только твердые кристаллические вещества, растворимые в воде. Кристаллические растворимые вещества (соль, сахар, аммиачная селитра и др.), поглощая влагу из воздуха, расплываются и полностью растворяются в ней, то есть гигроскопический процесс для растворимых веществ (deliquescence) – это абсорбция влаги из воздуха. Гигроскопические процессы с противоположной направленностью: – десорбция воды, сушка. Влага, как правило, является вредной примесью и её уровень всегда контролируется в технических продуктах, выпускаемых промышленностью, то есть влага в этих продуктах всегда есть. Так как относительная влажность атмосферного воздуха постоянно изменяется, то знание гигроскопических свойств растворимых веществ и процессов, происходящих с ними, весьма актуально. Известны истории про отсыревший порох, про слеживаемость аммиачной селитры. Наверное, каждый из нас сталкивался с куском слежавшегося сахара или соли. Гигроскопичность растворимых веществ характеризуется их гигроскопической точкой. Гигроскопическая точка – это относительная влажность воздуха, при которой вещество не поглощает влагу и не подсыхает. Следствия из этого определения: если окружающий воздух будет иметь влажность ниже гигроскопической точки, то вещество будет подсыхать, если выше, то увлажняться. Количественно гигроскопическая точка (hг.т.) определяется как равновесное давление паров воды над образцом вещества (Рр-р), отнесенное к давлению паров чистой воды (РН2О) при той же температуре, и выражается в процентах относительной влажности воздуха (% отн. вл. в.) hг.т. = (Рр-р / РН2О) * 100 %; 1.1 Давление над образцом имеет индекс «р-р», такой индекс поставлен в связи с тем, что образцы растворимых веществ обычно характеризуются определенной влажностью, и эта влага присутствует на кристаллах растворимого вещества в виде раствора. Таким образом, равновесное давление паров воды над образцом твердого продукта – это давление паров воды над раствором, причем насыщенным раствором по основному компоненту, так как раствор находится в равновесии с кристаллами на поверхности кристаллов. Если проанализировать эту формулу, то обнаружим, что значение гигроскопической точки определяется давлением паров раствора, так как давление паров воды при определенной температуре – это константа (например, РН2О = 23,76 мм. рт. ст. или 3267 Па при 25 оС ). А вот давление воды над насыщенным раствором чистого вещества или технического продукта - это константа? Над раствором чистого вещества, конечно, константа. У технического продукта раствор на поверхности его кристаллов будет содержать не только основное вещество, но и примеси и, скорее всего, состав раствора будет различным в зависимости от влажности продукта, от технологии получения, от конкретной партии. Следовательно, давление паров воды над таким раствором константой не будет. Реактив в баночке с квалификацией «х.ч.» (химический чистый) – это чистое вещество или технический продукт? Возьмем, например, азотнокислый натрий «х.ч.» по ГОСТ 4168-79. У него нормируется ряд примесей таких, например, как ионы кальция (не более 0,002%), ионы магния (не более 0,001%). Если ионы пересчитать на нитраты магния и кальция, то в сумме получится 0,013% этих солей. Если влажность реактива 1 %, то содержание этих примесей в растворе будет в сумме 1,3 % (исходим из предположения, что эти примеси полностью перешли в раствор). Возможно, их содержание не повлияет на величину гигроскопической точки азотнокислого натрия равную 74 % отн. вл. в. при 25 оС. Но, если влажность реактива 0,05 %, то суммарная концентрация только этих примесей в растворе может составлять 26 % - этом случае гигроскопическая точка продукта с такой влажностью будет существенно ниже, ниже 50 % отн. вл. в. Таким образом, Рр-р в рассматриваемой формуле для технического продукта не является константой. Уже такой простой анализ показывает, что гигроскопические свойства растворимых продуктов сильно зависят: а) от наличия примесей в продукте б) от влажности продукта.
|
|
1.2. Гигроскопичность чистого вещества Рассмотрим гигроскопичность чистого вещества. Чистое вещество определим как вещество (продукт), не содержащее примесей, а если и содержащее, то их влиянием на конкретное свойство можно пренебречь. Для анализа гигроскопических свойств растворимого вещества рассмотрим систему «Вещество – влажный воздух» в равновесном (квазиравновесном) состоянии при увеличении относительной влажности воздуха (φ) от нуля до 100 % отн. вл. в. Система состоит из газовой и конденсированной фаз, которые находятся в равновесии. В газовой фазе нас будут интересовать только пары воды. Конденсированная фаза может представлять собой: - сухие кристаллы вещества; - смесь кристаллов и насыщенного раствора; - насыщенный раствор; - ненасыщенный, разбавленный раствор. Рассмотрим зависимость равновесного количества поглощаемых паров воды веществом сухим веществом (влагосодержание вещества - W) от относительной влажности воздуха, то есть изотерму абсорбции паров воды чистым растворимым веществом (рис. 1.1) [3]. W = МН2О * 100 / Мв-ва, % масс., 1.2 где МН2О – масса поглощенных паров воды, в граммах, Мв-ва - масса сухого вещества, в граммах. Начало графика изотермы будет совпадать с началом координат: в равновесии с сухим воздухом (φ = 0 % отн. вл. в.) может будет быть только сухое вещество (W= 0 % ), просто в этот момент в системе нет воды. Начинаем увеличивать относительную влажность воздуха. Рассмотрим равновесие в системе в некоторой точке i (0 < φi < h*г.т., где h*г.т. – гигроскопическая точка чистого вещества). В газовой фазе влага есть, но есть ли она в конденсированной фазе? Предположим, что она появилось, вещество увлажнилось, но в соответствии с определением гигроскопической точки, это может произойти быть только тогда, когда будет больше h*г.т., а у нас φ ниже. Следовательно, предположение, что вещество увлажнилось не верно, в точке i конденсированная фаза не может содержать гигроскопическую (абсорбированную) влагу в равновесных условиях. Таким образом, вещество будет сухим при любой относительной влажности воздуха ниже h*г.т.. Даже если чистое вещество было влажным, то оно обязательно (рано или поздно) высохнет полностью до нуля при любой относительной влажности воздуха, которая будет ниже его гигроскопической точки. Рассмотрим некоторые условия, связанные с изучением гигроскопических свойств растворимых веществ, чтобы в дальнейшем не возникало лишних вопросов. Хотя мы будем рассматривать влагосодержание (содержание массы влаги в продукте, отнесенное к массе сухого вещества, в % масс.) веществ в широком диапазоне значений, но с практической точки зрения нас будет интересовать влагосодержание веществ от 0,05 до 5 % - это обычное влагосодержание технических продуктов. Отметим, что численные значения влагосодержания и значения влажности (содержание массы влаги в продукте, отнесенное к массе влажного вещества, в % масс.) веществ в этом диапазоне мало отличаются друг от друга. Если влагосодержание измеряем взвешиванием на обычных аналитических весах (в граммах до 4 знака после запятой) и обычных навесках (примерно 1 – 2 грамма), то чувствительность метода измерения влагосодержания (влажности) составит порядка 0,01 - 0,02 % масс., и этого достаточно для достоверности проводимых исследований. Гигроскопический процесс для растворимых веществ - абсорбция влаги из воздуха. Существует еще адсорбция, когда сорбция влаги осуществляется только поверхностью твердого вещества, но при мономолекулярной адсорбции для растворимых веществ адсорбция составляет менее 0,01 % масс., то есть не превышает чувствительности методики измерения влагосодержания веществ. Поэтому, рассматривая гигроскопичность растворимых веществ, не будем вспоминать про адсорбцию, так как ее вклад в общую сорбцию пренебрежимо мал. Постепенно увеличивая влажность воздуха в системе, мы перемещаемся по линии W= 0 % и подходим к точке Б. Когда φ станет чуть выше h*г.т, то часть воды из газовой фазы переместится в конденсированную фазу в соответствии со следствием определения гигроскопической точки. После установления равновесия в системе получим: φ = h*г.т., а W ≈ 0, влагосодержание конденсированной фазы больше нуля на минимальную величину (ниже чувствительности метода определения влажности), и мы попадаем в точку Б на изотерме (рис. 1.1). Она интересна тем, что в ней на кристаллах вещества появляется первая микрокапля насыщенного раствора. В точке Б конденсированная фаза содержит минимальное количество воды, в виде насыщенного раствора, и равновесная относительная влажность воздуха над этим раствором равна h*г.т.. Добавим существенное количество паров воды в систему. После установления равновесия (точка j) вся вода, добавленная в газовую фазу системы, переместится в конденсированную фазу. При этом относительная влажность в системе φ не изменится, останется равной h*г.т., а влагосодержание будет иметь вполне определенную измеряемую величину Wj. В установившемся равновесном состоянии конденсированная фаза будет представлять собой смесь кристаллов и насыщенного раствора. Продолжая добавлять понемногу пары воды в систему и каждый раз после этого добиваясь установления равновесия в системе, мы будем двигаться строго вертикально вверх (рис.1.1), так как. W будет увеличиваться, а φ будет всегда равна h*г.т.. Как при Wj, так и при Wk насыщенный раствор вещества будет иметь один и тот же состав и его характеристики будут неизменны, в частности, относительное давление паров воды над насыщенным раствором будет равно h*г.т.. Будет меняться только соотношение между кристаллами и раствором в конденсированной фазе. Добавляя пары воды в систему, мы дойдем до такого состояния, когда в системе останется последний не растворившийся микрокристалл вещества, то есть мы попадем в точку А. В точке А относительная влажность воздуха также равна h*г.т., а конденсированная фаза содержит минимальное количество твердой фазы (кристаллов), меньше чувствительности метода определения. Но раствор является насыщенным, так как находится в равновесии с кристаллами вещества, хотя этих кристаллов минимальное количество. Таким образом, точка А характеризует насыщенный раствор (h*г.т., W*, индекс * относится к насыщенному раствору чистого вещества). Состав этого раствора можно принять равным составу конденсированной фазы, причем влагосодержание вещества (W*), соответствующее насыщенному раствору равно величине, обратной растворимости вещества в воде.
|
|
|
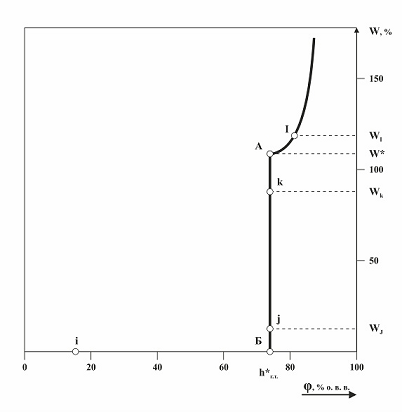 Добавим существенное количество паров воды в систему. После установления равновесия (точка j) вся вода, добавленная в газовую фазу системы, переместится в конденсированную фазу. При этом относительная влажность в системе φ не изменится, останется равной h*г.т., а влагосодержание будет иметь вполне определенную измеряемую величину Wj. В установившемся равновесном состоянии конденсированная фаза будет представлять собой смесь кристаллов и насыщенного раствора.
Добавим существенное количество паров воды в систему. После установления равновесия (точка j) вся вода, добавленная в газовую фазу системы, переместится в конденсированную фазу. При этом относительная влажность в системе φ не изменится, останется равной h*г.т., а влагосодержание будет иметь вполне определенную измеряемую величину Wj. В установившемся равновесном состоянии конденсированная фаза будет представлять собой смесь кристаллов и насыщенного раствора.
|
|
|
|
Таблица 1.1 Изотерма абсорбции паров воды нитратом натрия при 25 оС Относительная влажность воздуха, φ, % отн. вл. в. 73,9 73,9 74,0 75,0 76,0 78,0 80,0 85,0 Равновесное влагосодержание, W, % масс. 0 108,6 109,1 114,5 120,2 133,0 148,4 205,2 Графическое представление более наглядно, но в качестве справочного материала лучше табличное представление изотермы абсорбции с конкретными значениями величин. Сведения о гигроскопических точках веществ см.
|
|
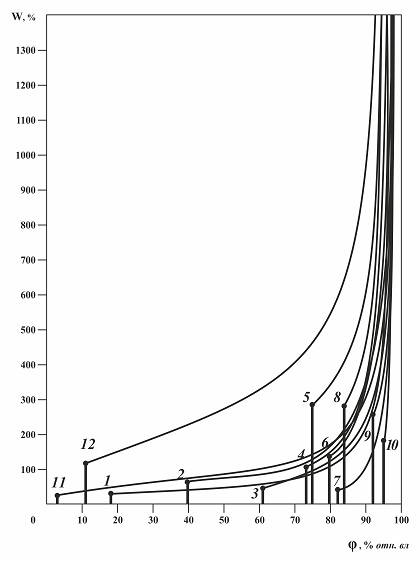
Рис.1.2. Изотермы абсорбции паров воды некоторыми солями при 25 оС. 1 – ZnI2, 2 – NaI, 3 – NH4NO3, 4 – NaNO3, 5 – NaCl, 6 – (NH4)2SO4, 7 – AgNO3, 8 – KCl, 9 – KNO3, 10 – Pb(NO3)2, 11 – 2ZnCl2*3H2O, 12 – LiCl*H2O О взаимосвязи влагосодержания насыщенных растворов и гигроскопических точек чистых веществ. Давление паров воды над насыщенными растворами растворимых веществ не нулевое и не равно давлению паров воды над чистой водой, оно между этими величинами. Соответственно значения гигроскопических точек растворимых веществ лежат между 0 и 100 % относительной влажности воздуха. Есть общее правило сильно растворимые вещества более гигроскопичны, мало растворимые вещества (вещества с большими значениями W) менее гигроскопичны. Гигроскопические точки плохо растворимых веществ очень близки к 100 %. На рис 1.2. приведены изотермы абсорбции некоторых распространенных солей. Видно, что изменение влагосодержания как насыщенных (W*), так и разбавленных (Wφ) растворов от относительной влажности воздуха не имеет простой четкой зависимости, наблюдается очень широкий разброс данных. Можно увидеть только общую тенденцию: от области низких значений W и φ по гиперболической кривой к области высоких W и φ. Простая взаимосвязь между значениями влагосодержаний насыщенных растворов W* (обратной растворимостью вещества в воде) и гигроскопических точек h*г.т. веществ четко не проявляется, даже для веществ с одинаковыми химическими свойствами, например для галогенидов метиламмония рис.1.3. Можно отметить, что более низкие гигроскопические точки у веществ с несимметричными молекулами (катионами), для таких веществ в определенной группе соединений обычно наблюдаются и более низкие температуры плавления.
|
|
|
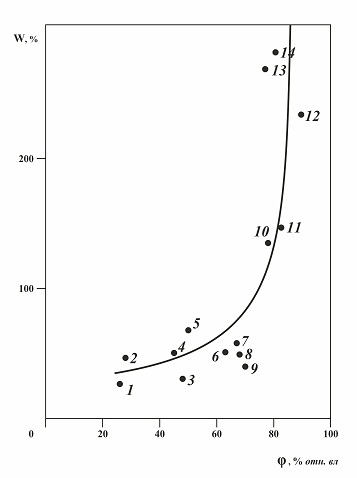 Рис.1.3. Зависимость влагосодержания насыщенных растворов от их гигроскопических точек на примере галогенидов метиламмония при 20 оС. 1 – (СH3)2NH2Cl, 2 – (СH3)3NHCl, 3 – (СH3)2NH2Br, 4 – СH3NH3Br, 5 – СH3NH3Cl, 6 – (СH3)3NHBr, , 7 – NH4I, 8 – СH3NH3I, 9 – (СH3)2NH2I, 10 – NH4Br, 11 – (СH3)4NBr, 12 – (СH3)3NHI, , 13 – NH4Cl , 14 – (СH3)4NCl. Влияние температуры на значение гигроскопической точки. Это влияние сильно связано с аналогичной зависимостью растворимости солей от температуры. Например, для нитрата натрия при увеличении температуры значение гигроскопической точки, а также и влагосодержание, заметно снижаются. Для хлорида натрия, растворимость которого слабо зависит от температуры, значение гигроскопической точки мало меняется от температуры, остается практически постоянным в пределах погрешности измерения.
Рис.1.3. Зависимость влагосодержания насыщенных растворов от их гигроскопических точек на примере галогенидов метиламмония при 20 оС. 1 – (СH3)2NH2Cl, 2 – (СH3)3NHCl, 3 – (СH3)2NH2Br, 4 – СH3NH3Br, 5 – СH3NH3Cl, 6 – (СH3)3NHBr, , 7 – NH4I, 8 – СH3NH3I, 9 – (СH3)2NH2I, 10 – NH4Br, 11 – (СH3)4NBr, 12 – (СH3)3NHI, , 13 – NH4Cl , 14 – (СH3)4NCl. Влияние температуры на значение гигроскопической точки. Это влияние сильно связано с аналогичной зависимостью растворимости солей от температуры. Например, для нитрата натрия при увеличении температуры значение гигроскопической точки, а также и влагосодержание, заметно снижаются. Для хлорида натрия, растворимость которого слабо зависит от температуры, значение гигроскопической точки мало меняется от температуры, остается практически постоянным в пределах погрешности измерения.
|
|
|
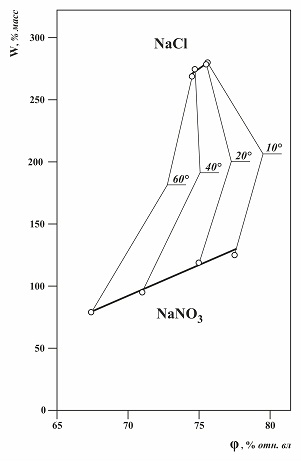 Рис.1.4. Влияние температуры на свойства насыщенных растворов нитрата натрия и хлорида натрия. Изменение гигроскопической точки – по горизонтальной оси, изменение влагосодержания – по вертикальной оси. Значение растворимости при оценке гигроскопических свойств. Из графиков на рис.1.2 видно, что влагопоглощение для многих веществ составляет десятки, сотни процентов. Если вещество поглощает влагу из воздуха при относительной влажности воздуха выше гигроскопической точки вещества, то в этом случае вещество полностью растворится в поглощаемой влаге еще до достижения равновесного влагопоглощения. На практике это случается редко, так как. процесс влагопоглощения достаточно длителен, поэтому может быть обнаружен, и контакт продукта с влажным воздухом прекращен. Кроме того, чаще уже малоинтересно десятки или сотни процентов воды поглощено продуктом, потому что даже после увлажнения до 5 %, раствор с кристаллов стекает, продукт необходимо сушить, либо браковать. При таком «небольшом» (5 %) количестве поглощенной влаги для характеристики гигроскопических свойств чистого вещества существенное значение приобретает его растворимость в воде. Рассмотрим увеличение влагосодержания до 5 % таких веществ как хлорид калия и нитрат серебра, имеющих примерно равные величины гигроскопических точек, но разную растворимость SKCl = 36 г / 100 г воды, SAgNO3 = 250 г / 100 г воды. Влагосодержание 5 % в этих продуктах приведет к тому, что в жидкую фазу перейдет 1,8 % хлорида калия и 12,5 % нитрата серебра, а соотношения между жидкой и твердой фазами будут равны 1:15 и 1:5. То есть если хлорид калия, содержащий 5 % влаги - это влажный кристаллический продукт, то нитрат серебра с 5 % влаги – это уже не твердый продукт, а суспензия, которая может течь и пр. Таким образом, для полной характеристики гигроскопичности чистого вещества полезно знать не только его гигроскопическую точку, но и растворимость в воде. Активность воды. В термодинамике, в частности в термодинамике растворов, вместо понятия «гигроскопическая точка» используется понятие «активность воды» в растворе - αw. αw = Рр-р/ РН2О = hр-р/ 100% 1.6 для насыщенного раствора α*w = Рнас./ РН2О = h*г.т./ 100% 1.7 где α*w - активность воды в насыщенном растворе чистого вещества. Активность воды – это давление паров воды над образцом любой природы, отнесенное к давлению паров воды над чистой водой при той же температуре. Активность воды – это единая термодинамическая характеристика воды, находящейся как в растворе, так и в газовой фазе, или твердой фазе. Активность воды выражается в безразмерных относительных единицах. Активность воды в воздухе – это термодинамическая величина, определяющая, в частности, направление движения и движущую силу процессов перемещения молекул воды в воздухе или в растворе. Пары воды перемещаются из области пространства с высокой активностью воды в область с низкой активностью воды до тех пор, пока активность воды в этих областях не выровняется. Движущей силой процесса является разность активностей воды рассматриваемых областей пространства. В дальнейшем термин активность воды в растворе и в воздухе будет использоваться как эквивалент относительной влажности воздуха или равновесной относительной влажности воздуха над раствором. Понятие «активность воды» широко используется в пищевой промышленности и сельском хозяйстве, так как обеспечивает дополнительную информацию (по сравнению с общей влажностью) о микробиологической, химической и ферментной стабильности скоропортящихся веществ, таких как продукты питания и семена.
Рис.1.4. Влияние температуры на свойства насыщенных растворов нитрата натрия и хлорида натрия. Изменение гигроскопической точки – по горизонтальной оси, изменение влагосодержания – по вертикальной оси. Значение растворимости при оценке гигроскопических свойств. Из графиков на рис.1.2 видно, что влагопоглощение для многих веществ составляет десятки, сотни процентов. Если вещество поглощает влагу из воздуха при относительной влажности воздуха выше гигроскопической точки вещества, то в этом случае вещество полностью растворится в поглощаемой влаге еще до достижения равновесного влагопоглощения. На практике это случается редко, так как. процесс влагопоглощения достаточно длителен, поэтому может быть обнаружен, и контакт продукта с влажным воздухом прекращен. Кроме того, чаще уже малоинтересно десятки или сотни процентов воды поглощено продуктом, потому что даже после увлажнения до 5 %, раствор с кристаллов стекает, продукт необходимо сушить, либо браковать. При таком «небольшом» (5 %) количестве поглощенной влаги для характеристики гигроскопических свойств чистого вещества существенное значение приобретает его растворимость в воде. Рассмотрим увеличение влагосодержания до 5 % таких веществ как хлорид калия и нитрат серебра, имеющих примерно равные величины гигроскопических точек, но разную растворимость SKCl = 36 г / 100 г воды, SAgNO3 = 250 г / 100 г воды. Влагосодержание 5 % в этих продуктах приведет к тому, что в жидкую фазу перейдет 1,8 % хлорида калия и 12,5 % нитрата серебра, а соотношения между жидкой и твердой фазами будут равны 1:15 и 1:5. То есть если хлорид калия, содержащий 5 % влаги - это влажный кристаллический продукт, то нитрат серебра с 5 % влаги – это уже не твердый продукт, а суспензия, которая может течь и пр. Таким образом, для полной характеристики гигроскопичности чистого вещества полезно знать не только его гигроскопическую точку, но и растворимость в воде. Активность воды. В термодинамике, в частности в термодинамике растворов, вместо понятия «гигроскопическая точка» используется понятие «активность воды» в растворе - αw. αw = Рр-р/ РН2О = hр-р/ 100% 1.6 для насыщенного раствора α*w = Рнас./ РН2О = h*г.т./ 100% 1.7 где α*w - активность воды в насыщенном растворе чистого вещества. Активность воды – это давление паров воды над образцом любой природы, отнесенное к давлению паров воды над чистой водой при той же температуре. Активность воды – это единая термодинамическая характеристика воды, находящейся как в растворе, так и в газовой фазе, или твердой фазе. Активность воды выражается в безразмерных относительных единицах. Активность воды в воздухе – это термодинамическая величина, определяющая, в частности, направление движения и движущую силу процессов перемещения молекул воды в воздухе или в растворе. Пары воды перемещаются из области пространства с высокой активностью воды в область с низкой активностью воды до тех пор, пока активность воды в этих областях не выровняется. Движущей силой процесса является разность активностей воды рассматриваемых областей пространства. В дальнейшем термин активность воды в растворе и в воздухе будет использоваться как эквивалент относительной влажности воздуха или равновесной относительной влажности воздуха над раствором. Понятие «активность воды» широко используется в пищевой промышленности и сельском хозяйстве, так как обеспечивает дополнительную информацию (по сравнению с общей влажностью) о микробиологической, химической и ферментной стабильности скоропортящихся веществ, таких как продукты питания и семена.
|
|
|
 |
|
|
|
|