1.5. Особенности химического состава природных вод Томской области |
1. Свойства и химия воды
1.1. Физические совйства воды
На земле нет другого такого соединения, которое обладало бы таким широким набором удивительных свойств, как вода.
1.1.1. Аномальные свойства воды
1. При замерзании вода расширяется, а не сжимается. Её объём увеличивается на 10%, а плотность соответственно уменьшается. Поэтому лед плавает и защищает зимой водоемы от промерзания.
2. Вода единственное вещество на земле, которое существует одновременно в 3-х агрегатных состояниях: твердом, жидком и газообразном.
3. У воды исключительно высокая величина поверхностного натяжения (σ), поэтому она способна подниматься по тонким капиллярам.
4. При нагревании от 0 до 4°С плотность воды увеличивается, а не уменьшается, как у других веществ. Максимальную плотность вода имеет при 4°С а не при 0°С. Плотность воды при 4°С и давлении 1 атм. принята за единицу плотности твердых и жидких веществ.
5. Диэлектрическая постоянная воды выше, чем у других жидкостей. Например, бензол – 2,3, хлороформ – 5,1, уксусная кислота – 21, вода – 81.
6. Вода обладает высокой теплоемкостью, в 3000 раз большей, чем воздух. Это значит, что при охлаждении 1м3 воды на 1° на столько же нагревается 3000 м3 воздуха.
1.1.2. Структура воды
Жидкая вода, соответствующая формуле Н2О в естественных условиях не существует. Полностью соответствует формуле Н2O лишь вода, находящаяся в парообразном состоянии. Много ученых работают над решением трудной проблемы получения абсолютно чистой воды. Но пока получить такую воду не удалось. Вода, близкая по составу формуле Н2О, находится только в нескольких лабораториях мира, как эталон.
Необычные (аномальные) свойства воды были загадкой для ученых. Выяснилось, что они обусловлены тремя причинами:
- полярным характером молекул;
- наличием неподеленных электронных пар у атомов кислорода;
- образованием водородных связей.
Итак, молекула воды (H2O) состоит из двух атомов водорода (H) и одного атома кислорода (O). Оказывается, что едва ли не все многообразие свойств воды и необычность их проявления определяется, в конечном счете, физической природой этих атомов, способом их объединения в молекулу и группировкой образовавшихся молекул.
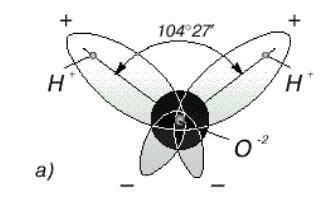
В отдельно рассматриваемой молекуле воды атомы водорода и кислорода, точнее их ядра, расположены так, что образуют равнобедренный треугольник. В вершине его - сравнительно крупное кислородное ядро, в углах, прилегающих к основанию, - по одному ядру водорода.
Модель молекулы воды, предложенная Нильсом Бором, показана на рис. 1.1а. В соответствии с электронным строением атомов водорода и кислорода молекула воды cодержит пять электронных пар. Они образуют электронное облако. Облако неоднородно - в нем можно различить отдельные сгущения и разрежения. У кислородного ядра создается избыток электронной плотности. Внутренняя электронная пара кислорода равномерно обрамляет ядро: схематически она представлена окружностью с центром - ядром O2 - (рис. 1.1а). Четыре внешних электрона группируются в две электронные пары, тяготеющие к ядру, но частично не скомпенсированные. Схематически суммарные электронные орбитали этих пар показаны в виде эллипсов, вытянутых от общего центра – ядра O2. Каждый из оставшихся двух электронов кислорода образует пару с одним электроном водорода. Эти пары также тяготеют к кислородному ядру. Поэтому водородные ядра – протоны, оказываются несколько оголенными, и здесь наблюдается недостаток электронной плотности. Таким образом, в молекуле воды различают четыре полюса зарядов: два отрицательных (избыток электронной плотности в области кислородного ядра) и два положительных (недостаток электронной плотности у двух водородных ядер).
Рис. 1.1а. Строение молекулы воды. Угол между связями О-Н